García Rodríguez AM., Sánchez Velasco M. , Borrego Pintado MH. EuroEco 2021;10(1):17-24.
|
Ana María García Rodríguezᵃ , Miguel Sánchez Velascoᵇ y María Henar Borrego Pintado c ᵃ Especialista en Medicina Familiar y Comunitaria y Especialista en Análisis Clínicos, Centro de Salud de Laguna de Duero (Valladolid), ᵇ Especialista en Medicina Familiar y Comunitaria y Especialista en Medicina Legal y Forense, Gerencia de Emergencias de Castilla y León, UME de Medina del Campo (Valladolid) c Especialista en Anatomía Patológica, Servicio de Anatomía Patológica del Hospital Clínico Universitario de Valladolid
|
INFORMACION DEL ARTICULO |
R E S U ME N | ||
On-line el 10 de Febrero de 2021 |
©Sociedad Española de Médicos Generales y de Familia Publicado por Ecosemg Galicia.
|
||
Palabras clave:Patrón intersticial, ecografía pulmonar, bronquiolitis, líneas B, tos. |
|||
| Chronic Cough: Interstitial lung disease on lung ultrasound.
A B S T R A C T |
|||
Keywords:Interstitial pattern, lung ultrasound, bronchiolitis, B lines, cough. |
Ultrasonography is an exceptional ally in pulmonary exploration; the visualization of diffuse B lines constitutes the ultrasound pattern of the interstitial pattern. A clinical case of a man with chronic cough and fine crackles is presented, who underwent pocket ultrasound in a Primary Care (PC) consultation. The definitive diagnosis is Respiratory Bronchiolitis associated with Interstitial Pulmonary Disease (BR-ILD). |
Caso Clínico
| Varón de 67 años que acude a consulta por tos productiva con expectoración blanquecina sin fiebre asociada, con disnea a moderados esfuerzos de varios meses de evolución. En ocasiones ha presentado dolor paraesternal a punta de dedo resuelto parcialmente. Percibe sibilancias con los accesos de tos.
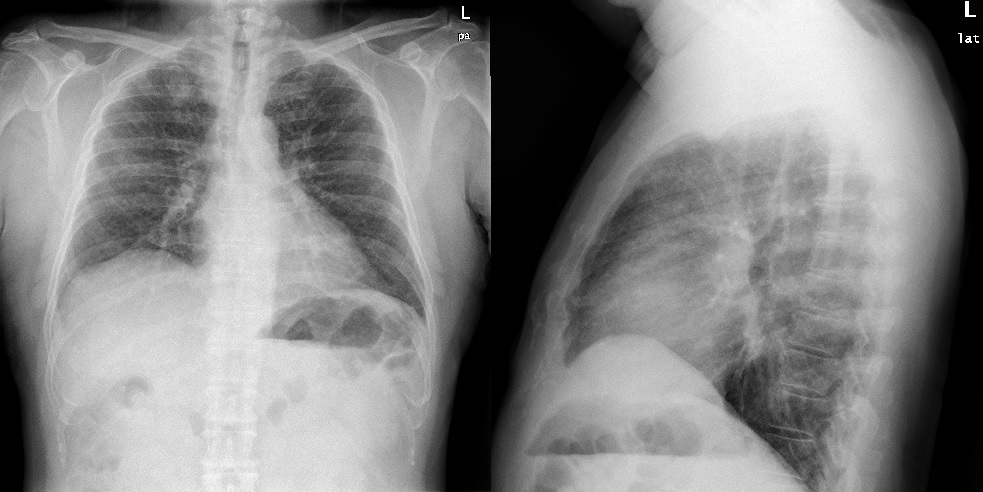
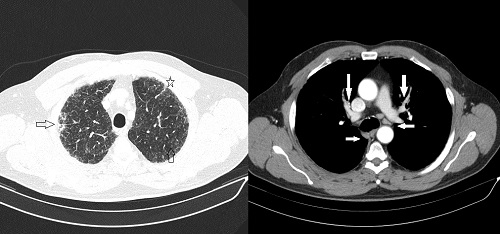
Practica ejercicio físico diario y aprecia una merma de su capacidad respiratoria. Sin pérdida ponderal ni hiporexia. En los antecedentes personales no se recogen alergias medicamentosas conocidas, exfumador desde hace 27 años (fumó 30 cigarrillos/día desde los 20 años), hernia discal lumbar L5-S1, osteoartrosis y sin tratamiento medicamentoso habitual. No refiere viajes al extranjero, ni contacto con animales. De profesión Personal de mantenimiento de empresa de neumáticos, actualmente jubilado. En la exploración física la saturación de oxígeno es del 99% con 75 lpm sin tiraje ni trabajo respiratorio, no reflujo esofágico, no rinorrea y sin sospecha de goteo postnasal, no adenopatías locorregionales y sin síntomas B. La auscultación cardiopulmonar revela crepitantes finos en bases en “velcro” con ruidos cardiacos rítmicos sin soplos. Se inicia un tratamiento escalonado a lo largo de distintas semanas de consulta, probando distintas estrategias que abarcan la carbocisteína, codeína, cloperastina, corticoterapia inhalada con broncodilatadores de corta y larga acción (b2 agonistas y anticolinérgicos), aerosolterapia e incluso antibioterapia empírica. Mientras, se le efectúan diferentes pruebas complementarias. Entre dichas exploraciones se solicita una radiografía de tórax en la que se aprecia un patrón intersticial difuso sin condensaciones y sin cambios con respecto a radiografías previas (Figura 1 ). Pick- Flow en consulta con un valor normal de 550-600 ml. La Espirometría arroja los siguientes resultados: FVC: 2.76 L (83.6%), FEV 1:2.35L (91.2%), FEV1/FVC 0.83, MMEF 75/25 97.4%, Test Broncodilatador negativo con una ganancia del 2%. En analítica de sangre destaca eosinofilia de 1 x 1000/μL (vn 0.1-0.65), LDH 220 U/L (vn 110-210), Proteína C Reactiva N. Estudio bacteriológico de esputo con tinción de Gram y cultivo de bacterias aerobias normal. Prueba de Mantoux negativa. Una analítica posterior completa el estudio con alergias con resultado negativo para neumoalergenos y serología de neumonías atípicas, valor de Inmunoglobulina E de 202 U/mL (vn 0-100), proteinograma normal e incremento de LDH de 273 U/L. Ante la persistencia de unos síntomas que no remiten tras distintos tratamientos se decide derivación al servicio de Neumología para estudio de tos crónica. Allí se realiza exploración por TAC de alta resolución (TACAR) de tórax en la que destaca la existencia de imágenes nodulares mal definidas en vidrio deslustrado de predominio centrolobular que afecta sobre todo a campos medios y superiores. También se observan mínimos nódulos subpleurales en ambos hemitórax. Existen signos de engrosamiento de los septos interlobulillares y mínimas bronquiectasias de tracción de distribución subpleural de distribución difusa. Adenopatías mediastínicas inferiores a 1 cm a nivel paratraqueal derecho, traqueobronquiales, ventana aorto pulmonar e hiliares bilaterales. Conclusión: con los hallazgos radiológicos descritos se establece el diagnóstico diferencial de neumonitis por hipersensibilidad en fase crónica o bronquiolitis respiratoria asociada a enfermedad intersticial pulmonar. (Figura 2) Además se efectúa estudio de la Capacidad de difusión pulmonar de monóxido de carbono (DLCO), el cual muestra un grado de alteración ligero, según porcentajes del valor predicho: 73.8 % (vn 85-120%), y DLCO ajustada por volumen alveolar, KCO (DLCO/VA): 106.2% (vn >80%). Para calcular los volúmenes pulmonares estáticos se realiza una Pletismografía, la cual arroja también valores en rangos dentro de la normalidad: Volumen Residual (RV):91.4% (vn 65-120%), gas intratorácico al final de la espiración a volumen corriente (ITGV) 82,5% (vn >80%), Volumen Corriente (VC) 89.1%, Capacidad Pulmonar Total (TLC) 87,8 % (vn 80-120%), RV/TLC 104%, ITGV/TLC 90.9%. El Test de la marcha de los 6 minutos (PM6M) muestra los siguientes resultados: Inicial: saturación de oxígeno de 96%, frecuencia cardiaca 90 lpm, disnea 0, fatiga de extremidades inferiores (escala Borg modificada) 2 (leve). Final: saturación de oxígeno 94%, frecuencia cardiaca 115 lpm, disnea 0, fatiga de extremidades inferiores 3-4 (moderada-algo grave), con una distancia recorrida de 500 metros y sin incidencias. A continuación se hace un ingreso programado para formalizar Fibrobroncoscopia y toma de muestras para broncoaspirado (BAS), lavado broncoalveolar (BAL) y biopsia transbronquial, con los siguientes resultados: BAS y BAL con microbiología negativa en ambos casos y diagnóstico anatomopatológico de inflamación aguda y lavado alveolar negativo respectivamente. El estudio de citometría de flujo arroja un 28 % linfocitos TCD3+ (vn 60-90%), con cociente CD4/CD8= 24/76 = 0.3 (vn 1.4 -1.8) En la biopsia transbronquial la anatomía patológica aporta una valoración de mínimos cambios inespecíficos. A los 3 meses de la previa, se repite una Rx de tórax de control, en la que no se aprecian cambios, así como una nueva analítica. Los valores reflejan eosinofilia 0,7 x 1000/μl (vn 0.1-0.65), eosinófilos 8.7 % (vn 0-6.2), resto de sistemático y coagulación n. Bioquímica con glucosa 126 mg/dL, uratos 7.27 mg/dL, colesterol total 258 mg/dL Ig E 250 U /mL (vn 0-100), Ig A, Ig G, IgM,C3 y C4 normales. ANA, ANCA y AMA negativos. El juicio clínico emitido es de Enfermedad Pulmonar Intersticial (EPID) a estudio, por lo que remite a Cirugía torácica para realización de biopsia quirúrgica y filiación. Durante el proceso, el paciente sigue viniendo a nuestra consulta, refiriendo continuar sintomático y con sensación de que su patología no llega a diagnóstico, ni se le ofrece un tratamiento resolutivo que restablezca su situación. Coincidiendo con la nueva adquisición por nuestra parte de un ecógrafo portátil con doble sonda, se decide completar estudio con una ecografía pulmonar en consulta de Atención Primaria (AP). Las imágenes obtenidas son reveladoras de su patología: se observan líneas B difusas atravesando toda la pantalla desde la pleura visceral, que se desplazan con los movimientos respiratorios y ninguna línea A. Dichas imágenes se obtienen tanto en el modo pulmonar, con sonda sectorial de baja frecuencia 3,5 a 5 MHz, como en el modo superficial musculoesquelético cambiando a la sonda lineal de alta frecuencia 7,5 a 12 MHz. Y, tanto en campos pulmonares anteriores como posteriores, a distintas alturas. Lo cual corrobora el patrón intersticial definido primero en radiografía de tórax y luego en el TAC.(video 1 ) y (video 2). Cuando al paciente se le muestra visualmente y comenta el significado de los hallazgos, parece tranquilizarse, y satisfacer, al menos parcialmente, su necesidad de conocimiento en lo referente a la repercusión de su patología. En días posteriores, recibe notificación de ingreso para intervención quirúrgica por biopsia pulmonar. En dicho proceso operatorio se observa una superficie pulmonar de aspecto antracótico y se biopsia lóbulo superior e inferior izquierdos. Dos envases en formol son remitidos al Servicio de anatomopatología. En un envase, un segmento de tejido pulmonar con sutura mecánica que mide 3,5 x 1,2 cm, de coloración negruzca de aspecto antracótico. Otro envase, con segmento de tejido pulmonar procedente de parénquima pulmonar de lóbulo superior izquierdo de 3 x 1 cm, peso 3 gr y macroscópicamente similar al anterior. Ambos en inclusión total (Bloques A1-A3 y B1-B3 respectivamente). La descripción por microscopia es la siguiente: histológicamente ambos pulmones muestran una morfología similar. La arquitectura general está conservada, no identificándose microquistes, ni presencia de granulomas. Hay un ligero enfisema, con algunos pequeños focos de fibrosis periférica, subpleural. Se identifican pequeñas áreas de hiperplasia de músculo liso y un ligero infiltrado inflamatorio de tipo crónico, con eosinófilos aislados. Se observan focos de metaplasia bronquiolar, con escasa fibrosis peribronquiolar, y, no muy numerosos macrófagos con pigmento en los espacios alveolares. Con técnicas de histoquímica se confirma la presencia de una escasa y ligera fibrosis periférica, de aspecto cicatricial. El diagnóstico anatomopatológico define un parénquima pulmonar con arquitectura conservada con hallazgos compatibles con Bronquiolitis Respiratoria asociada a Enfermedad Pulmonar Intersticial. (Figura 5) El paciente continúa con tos a pesar de inhaladores con budesonida/formoterol que no tolera por importante disfonía. De nuevo en el servicio de neumología, se inicia corticoterapia con prednisona 40 mg /24h 1 mes para continuar con 30 mg/24 h dos meses y revisión; mientras, aunque mantiene la misma sintomatología inicial, permanece con buena calidad de vida y aceptablemente satisfecho del seguimiento y atención de los que está siendo objeto. |
Figura 1. Radiografía posteroanterior y lateral de tórax en las que se aprecia patrón intersticial difuso en “vidrio deslustrado”.
Figura 2. TAC de campos pulmonares medios. En imagen de izquierda se observa engrosamiento septos interlobulillares, pequeñas bronquiectasias de tracción periféricas y algún nodulillo centrolobular. A la derecha adenopatías hiliares bilaterales, paratraqueales derechas, traqueobronquiales y en ventana aortopulmonar
Comentario
Una tos crónica persistente con poca repercusión clínica puede ser analizada al pie del paciente, desde el punto de vista ultrasonográfico, con una alta probabilidad de certeza diagnóstica y ya en un primer escalón de protocolo diagnóstico.
La ecografía podría convertirse en herramienta indispensable para el diagnóstico, el seguimiento y la monitorización postratamiento de la patología pulmonar, ya que ésta tiene una manifestación más precoz e incluso más precisa que la radiológica¹. Además, presenta una alta correlación con el TAC torácico; y, no sólo en emergencias y en cuidados intensivos (Protocolo BLUE para la evaluación rápida de la disnea aguda)1,2,3 también en la consulta de AP y en la cabecera del paciente en su domicilio.
Los ultrasonidos (US) son una herramienta inocua, accesible, repetible, dinámica, fisiopatológica¹ y rápida. Es, sin embargo, observador dependiente, aunque con un alto grado de reproducibilidad inter e intraobservador; con una curva de aprendizaje relativamente corta para la identificación de la enfermedad pulmonar, y en concreto de la enfermedad que tratamos. Otras limitaciones incluyen las dificultades de visualización de patología alejada de la pleura o de localización del lóbulo pulmonar en caso de atelectasia o parálisis diafragmática. También pueden ser elementos de confusión las variantes anatómicas como cisuras accesorias o el exceso de panículo adiposo.
Cualquier cambio en la relación aire/líquido es clave en la génesis de artefactos originando patrones característicos que orientarán distintas patologías pulmonares: neumotórax; mínimo derrame pleural (no detectable por radiología ni en decúbito lateral : >5 y < 10 ml); parénquima pulmonar: patrón intersticial, consolidación alveolar adyacente a pleura, necrosis, abscesos, atelectasias o pulmón normal; pared torácica y diafragma.2,3
Los US presentan una gran exactitud, validez y confianza en el diagnóstico del síndrome alveolo intersticial a la cabecera del paciente, con la detección y localización de edema subpleural intersticial, fase previa al edema alveolar2,4,6.
El patrón intersticial se extiende a pulmón periférico, esto se traduce en un artefacto en forma de cometa, las líneas B, dando un patrón característico cuando son numerosas (lung rockets o B-Plus). Son el resultado de la reverberación de los haces de ultrasonidos al reflejarse los septos interlobulillares engrosados; áreas en vidrio deslustrado adyacentes a pleura; agua extravascular o espesamiento intersticial ¹, en el Modo B (imagen bidimensional en tiempo real). Son características las líneas B difusas o en número mayor a tres, hiperecogénicas, acompañando los movimientos respiratorios, atravesando toda la pantalla desde la pleura visceral y borrando las líneas A horizontales, paralelas a pleura, que aparecen en un pulmón normal seco. Presentan una sensibilidad 93,4 % y especificidad 93 % frente al 72 % de la radiología convencional¹. Aunque la naturaleza del engrosamiento de los septos, sea por edema o por acúmulo de tejido fibroso, no diferencia el tipo de artefacto¹ . Sí es indicativo la distancia entre las líneas, así como el número de las mismas.
Unas líneas B distanciadas más de 7 mm en número de 3 ó más caracterizan unas Líneas B representativas del engrosamiento del septo interlobular subpleural con distribución regular (patrón septal en el edema intersticial)⁷. La distancia de 3 mm entre las líneas B difusas son típicas del edema alveolar (áreas en vidrio deslustrado), al que también se ha denominado pulmón blanco⁷.
Siguiendo las recomendaciones internacionales basadas en la evidencia tras la Conferencia de Consenso de 2012, se recomienda realizar la exploración en un mínimo de ocho zonas (4 anteriores, dos laterales y 2 posteriores) en ambos pulmones, en espacios intercostales y posición longitudinal de la sonda. Aunque, en ocasiones, puede ser suficiente la exploración rápida de dos regiones; o bien, de forma exhaustiva, la evaluación de 28 espacios intercostales. Siendo siempre necesario el recuento de 3 ó >3 líneas B en un patrón intersticial (Nivel de evidencia A).⁴
El examen será positivo cuando los hallazgos se encuentren en dos ó más regiones bilaterales contando las líneas B o calculando el porcentaje de espacio intercostal ocupado por líneas B, si éstas confluyen. (Nivel de evidencia B). El número de líneas hallado ofrecerá una valoración semicuantitativa de la gravedad: leve (3/5-15); moderada (15-30) y grave (>30).
Múltiples líneas B son indicativas de síndrome intersticial, y pueden encontrarse de forma difusa o localizada, pero también en un pulmón normal. Las causas del mismo pueden ser: SDRA (síndrome del distrés respiratorio del adulto), edema pulmonar, neumonía intersticial o pneumonitis y enfermedad difusa del parénquima pulmonar (fibrosis pulmonar). En contraste con el edema agudo de pulmón, ésta última incluye anormalidades pleurales y subpleurales y líneas B no homogéneas en distribución, lo cual admite una buena correlación con el TAC con una alta sensibilidad y especificidad (nivel de evidencia B), considerada prueba gold stardard.⁶
Los ultrasonidos son superiores a la Radiología de tórax para descartar un síndrome intersticial ante la sospecha del mismo (Nivel de evidencia B). De hecho, la sensibilidad radiológica en fases iniciales es baja, con desacuerdo interobservador hasta de un 30 %.
Existe una probable correlación de las líneas B ultrasonográficas con las líneas B Kerley en Rx torácica. ⁸ Así, son consideradas marcador ecográfico del síndrome intersticial asociado a las enfermedades del colágeno⁹ y útiles en la detección temprana del mismo¹⁰, así como en la monitorización del reclutamiento alveolar tras ventilación mecánica en pulmones poco aireados.¹¹
La incidencia de EPI (enfermedad pulmonar inflamatoria o enfermedad pulmonar infiltrativa difusa, EPID) se estima en 31,5 casos por cada 100.000 varones y 26,1 casos por cada 100.000mujeres¹².
La Bronquiolitis respiratoria asociada a enfermedad intersticial (BR-EPI) es una lesión histopatológica que afecta a fumadores activos en los 30 a 40 años con más de 30 paquetes al año (90%) ¹³. De leve predominio en el sexo masculino e inico subagudo en semanas o meses. En el examen físico los crepitantes inspiratorios se encuentran en el 50 % de los casos, en ocasiones también son espiratorios y el hipocratismo digital se observa en un 25 %.
Pertenece al grupo de las enfermedades parenquimatosas difusas con patrón de inflamación y fibrosis en intersticio y pequeñas vías aéreas. Cuando se hace sintomática (cursa con disnea progresiva y tos) las pruebas de función respiratoria suelen mostrar un patrón obstructivo y/o restrictivo (que no ocurre en el caso presente) y una disminución de la DLCO (que sí se da). El BAL muestra macrófagos con inclusiones marrones, doradas y negras similares a las de sujetos asintomáticos.
Los hallazgos radiológicos principales son el engrosamiento de las paredes de bronquios periféricos o centrales, opacidades y sombras periféricas e infiltrados intersticiales reticulares (60%). Puede ser normal en un 14-28 % de los casos¹⁴. En el TACAR destaca la atenuación en vidrio esmerilado difuso o parcheado, nódulos centrilobulillares y engrosamiento de la pared de vías aéreas centrales y periféricas. Es común el enfisema centrilobular leve en lóbulos superiores con áreas de hipoatenuación por atrapamiento aéreo y engrosamiento intersticial interlobar. Son lesiones que también se pueden encontrar en fumadores asintomáticos, aunque son más leves y pueden ser reversibles si se deja de fumar. (Este no es el caso que nos ocupa, que abandonó el tabaco hace más de dos décadas).
Histológicamente se caracteriza por una inflamación de submucosa bronquiolar con acúmulo de macrófagos con citoplasma pigmentado color café (por su mayor contenido de hierro), el compromiso intersticial afecta fundamentalmente las zonas peribronquiolares del parénquima pulmonar, en parche. El epitelio respiratorio muestra hiperplasia y metaplasia cuboidal con extensión a septos y ductos alveolares. Puede haber enfisema centrolobulillar. ¹⁵
El diagnóstico diferencial incluye neumonitis por hipersensibilidad aguda (Alveolitis Alérgica Extrínseca), la neumonía descamativa intersticial y la neumonía intersticial no específica, siendo los principales elementos diferenciadores con estas dos últimas entidades la extensión y distribución de las lesiones ¹². Se ha planteado incluso que son diferentes estadios de una misma enfermedad asociada al consumo del tabaco.
Existen más de 200 entidades con síndrome intersticial, lo que hace imprescindible una estrecha colaboración interprofesional para llegar a un diagnóstico de certeza, que se establecerá combinando las características clínicas, radiológicas e histopatológicas¹⁵. La biopsia es esencial cuando la conjunción de clínica, radiología y valoración funcional no son determinantes.
El curso clínico suele ser estable y la mayoría de los pacientes mejoran con el solo hecho de dejar de fumar (no es el caso de nuestro paciente exfumador de larga evolución que tampoco se expone a ambientes como fumador pasivo) con importante resolución clínica y recesión de las lesiones radiológicas. Un pequeño número de pacientes responde favorablemente a los corticoides ( sin influencia por vía inhalatoria en nuestro paciente, si bien hizo un tratamiento de corta duración, semanas); otros tienen un curso fluctuante, e incluso meses o años después de dejar de fumar continúan con cambios permanentes en pulmón, o por largos periodos de tiempo, expresión de una reacción inflamatoria crónica consecuencia de la exposición a antígenos del cigarrillo (como puede ser el presente caso); y, un pequeño número de pacientes no eran fumadores¹⁴.
El pronóstico es bueno, no habiéndose reportado casos de decesos ni progresión a fibrosis pulmonar o a neumonía intersticial¹³.
Recordar:
- Una tos crónica puede ser analizada al pie del paciente, desde el punto de vista ultrasonográfico, ya en un primer escalón de protocolo diagnóstico.
- La ecografía aporta datos de forma más precoz e incluso más precisa que la radiología¹ y presenta una alta correlación con el TAC torácico
- Cualquier cambio en la relación aire/líquido es clave en la génesis de artefactos originando patrones característicos que orientarán distintas patologías pulmonares
- Los US presentan una gran exactitud, validez y confianza en el diagnóstico del síndrome alveolo intersticial.
- las líneas B difusas o en número mayor a tres, hiperecogénicas, acompañando los movimientos respiratorios, atravesando toda la pantalla desde la pleura visceral y borrando las líneas A horizontales, del pulmón normal, constituyen el patrón Intersticial.
La Bronquiolitis respiratoria asociada a enfermedad intersticial (BR-EPI) es una lesión histopatológica que afecta a fumadores activos en los 30 a 40 años con más de 30 paquetes al año (90%).
Vídeo 1: Ecografía pulmonar con sonda microconvex en campo pulmonar anterior medio, posición longitudinal intercostal, en la que se aprecian más de 5 Líneas B, algunas próximas (<3 mm) y otras más alejadas (>7 mm).
Vídeo 2: Ecografía pulmonar con sonda lineal de alta frecuencia, en la que se aprecian múltiples Líneas B.
Bibliografía
|
García Rodríguez AM., Sánchez Velasco M. , Borrego Pintado MH.EuroEco 2021;10(1):17-24.